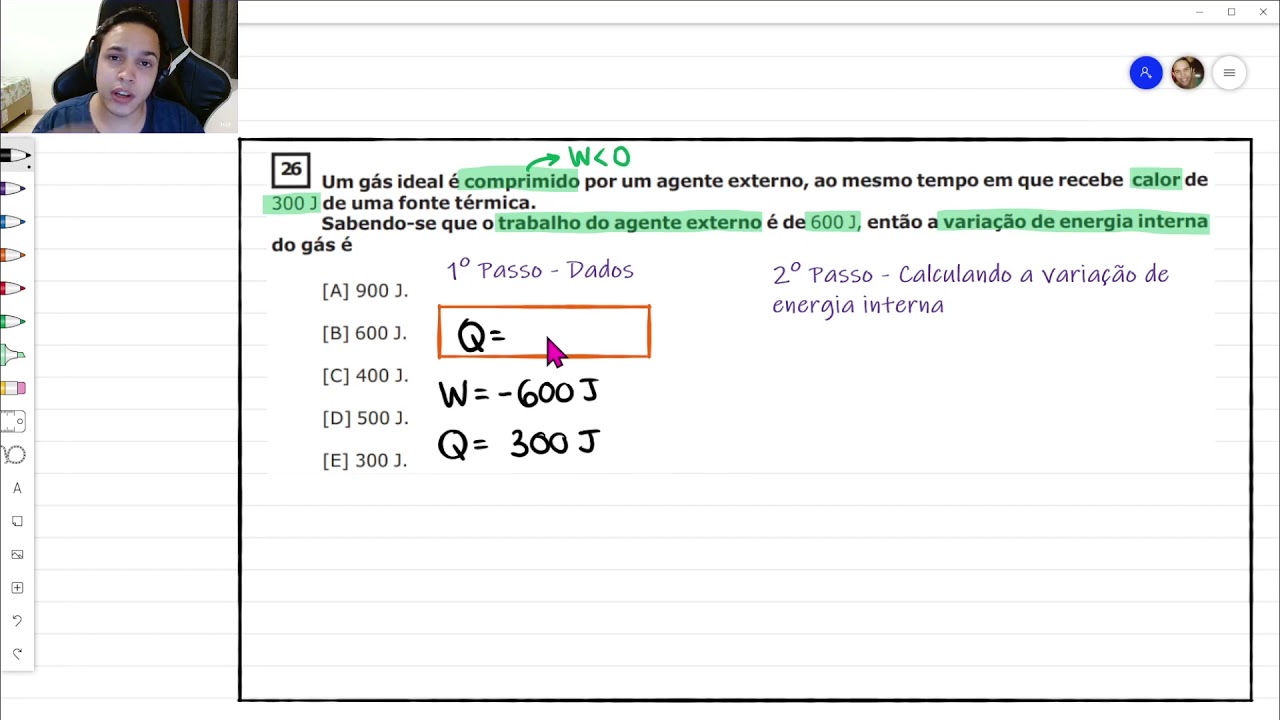
Um Gas Ideal é Comprimido Por Um Agente Externo
Um Gas Ideal é Comprimido Por Um Agente Externo em um vídeo
Quando um gás ideal é comprimido por um agente externo, sua pressão, temperatura e volume mudam. A pressão aumenta porque as moléculas do gás são forçadas a ocupar um espaço menor. A temperatura também pode aumentar, dependendo do tipo de compressão.
Existem dois tipos principais de compressão de gás ideal:
A compressão de um gás ideal tem vários efeitos, incluindo:
A compressão de um gás ideal é um processo reversível, o que significa que o gás pode ser expandido de volta ao seu estado original. No entanto, o processo de expansão não é isotérmico, pois o gás perde energia para o ambiente.
Quando um gás é comprimido, as moléculas do gás são forçadas a ocupar um espaço menor. Isso aumenta a frequência de colisões entre as moléculas, o que resulta em um aumento da pressão.
Em uma compressão isotérmica, o gás é comprimido em um recipiente isolado, de modo que não pode trocar calor com o ambiente. No entanto, a energia do gás é conservada, e a energia interna do gás aumenta. Como a temperatura é diretamente proporcional à energia interna, a temperatura do gás também aumenta.
A energia interna de um gás é a soma de todas as energias das moléculas do gás, incluindo a energia cinética, a energia potencial e a energia de interação entre as moléculas. Quando um gás é comprimido, a energia cinética das moléculas aumenta, o que resulta em um aumento da energia interna do gás.
Quando um gás é comprimido, o volume do gás é reduzido. Isso ocorre porque as moléculas do gás são forçadas a ocupar um espaço menor.
Aqui estão algumas fórmulas que podem ser usadas para calcular os efeitos da compressão de um gás ideal:
“`
PV = nRT
“`
onde:
* P é a pressão do gás
* V é o volume do gás
* n é o número de mols do gás
* R é a constante universal dos gases perfeitos
* T é a temperatura absoluta do gás
“`
W = PΔV
“`
onde:
* W é o trabalho realizado pelo gás
* P é a pressão do gás
* ΔV é a mudança no volume do gás
“`
U = nCV⋅T
“`
onde:
* U é a energia interna do gás
* n é o número de mols do gás
* CV é a capacidade calorífica molar à pressão constante do gás
* T é a temperatura absoluta do gás
Espero que esta discussão tenha sido útil.